MD Internista – Endocrinóloga – Oncología Endocrina
Fundación Santa Fe de Bogotá – Uniandes
Generalidades
- Incremento en la incidencia de cáncer, relacionado por detección mas temprana de la enfermedad, una mayor oportunidad de acceso a los servicios de salud.
- Incremento en la prevalencia del cáncer dado por una mayor poblacion de sobrevivientes debido a mejoria en las tecnicas de detección temprana y tratamiento .
- Probablemente el cáncer pueda llegar a exceder la enfermedad cardiovascular.Epidemiología de la osteoporosis en el paciente con cáncer
- El cáncer de próstata es la primera causa de cáncer en el hombre, y en EU corresponde al 25% de todos los canceres nuevamente diagnosticados.
- Tanto el carcinoma de mama, como el de próstata, son las neoplasias malignas mas estudiadas desde el punto de vista de metabolismo óseo.
- En un estudio de cohortes con 12368 pacientes con carcinoma de mama tratadas con inhibidores de aromatasa vs no inhibidor de aromatasa presentaron:
* Mayor perdida de masa osea 8,7% v 7,1% respectivamente con un RR 1,3, IC 95% 1,1 – 1,6 P: 0,01
* Mayor riesgo de fractura 13,5% vs 10,3% respectivamente con un RR 1,4 IC 95% 1,2 – 1,6 con P: 0,001
- En un estudio de revisión con 1043 pacientes con carcinoma de mama tratadas con inhibidores de aromatasa vs tamoxifeno
* Las mujeres con inhibidor de aromatasa tienen una probabilidad de 2,5 veces mas de sufrir de una fractura comparadas con mujeres tratadas con tamoxifeno.
- En un estudio con 50613 hombres con carcinoma de próstata sobrevivientes a los 5 años, se comparo los que recibieron Terapia de deprivación hormonal Vs pacientes sin terapia de deprivación hormonal
* El riesgo de fractura a los 5 años es de 19,4% vs 12,6% P: 0,001
o El riesgo de fractura se asoció con el numero de dosis de GnRH.
- En una revisión con 8577 hombres tratados con terapia de deprivación hormonal Vs no terapia de deprivación hormonal con seguimiento a 3 años se halló:
- Riesgo de fractura es de 18,7% Vs 14,6% con P:0,001 - Los pacientes que tienen carcinoma de próstata tienen una tasa de fractura de 8% añual cuando reciben deprivación hormonal y del 6,5% año sin deprivación hormonal con un valor de P:0,001.
Fisiopatología de la osteoporosis en paciente con cáncer: Mecanismos de enfermedad
- Osteoporosis relacionada directamente por actividad tumoral
* La enfermedad caracteristíca es el mieloma multiple
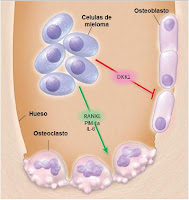 Las células malignas del mieloma producen focalmente perdida de hueso severa y liberan mediadores sistemicos produciendo
Las células malignas del mieloma producen focalmente perdida de hueso severa y liberan mediadores sistemicos produciendo Baja masa osea, hipercalcemia, lesiones líticas y fracturas patológicas
Incremento en la resorción/supresión de la formación y reparación osea
Entre los mediadores implicados en la estimulación del osteoclasto tenemos:• Sobreexpresion de RANKL /disminución de la osteoprotegerina
• Proteina inflamatoria del macrófago 1α• IL-6
• Incremento en VEGF
Adicionalmente tenemos supresión de la diferenciación del osteblasto a traves de
• Sobre expresión local (por las celulas del mieloma) y sistemica de DKK1 (dickkopf1): un antagonista de la vía de señalización Wnt.
* Otro mecanismo interesante lo tiene la Osteomalacia oncogenica
Esta patologia tiene expresion abundante de Factor de crecimiento Fibroblatico 23 (FGF 23), que induce hiperfosfaturia e hipofosfatemia
La fosfatasa alcalina esta elevada Marcada debilidad muscular
Dolor oseo marcado
Presencia de fracturas por fragilidad
Entre las causas tenemos el Hemangiopericitoma benigno y maligno; y reporte de un caso de osteosarcoma.
- Osteoporosis relacionada por tratamientos anti tumorales
* Multiples terapias pueden producir un estado hipogonadal, entre los cuales tenemos:
Menopausia prematura inducida por quimioterapia
Ablación ovárica deliberada
Uso de inhibidores de aromatasa para carcinoma de mama en mujer premenopausica y en mujer postmenopausica
Uso de tamoxifen en mujer premenopausica Supresion y/o ablación de la función ovárica en el cáncer de mama (mujer premenopausica)
• Goserelina (agonista de GnRH)• Anastrozole
* Terapia anti-androgenica para el carcinoma de próstata, la cual se puede realizar a traves de los siguientes mecanismos:
Cirugia – orquidectomia Medica: agonistas de la hormona liberadora de gonadotrofinas (GnRH) que producen
• Incremento en la resorción ósea• Reducción de la densidad mineral ósea
• Incremento en el riesgo de fractura en hombres con cáncer de próstata
Falla ovárica permanente inducida por quimioterapia (en mujer premenopausica; entre ellas:
• las antraciclinas producen falla ovárica en el 50% de casos
• La Ciclofosfamida, el Metrotexate y fluoracilo producen falla ovárica entre el 63 – 85%.
* El Imatinib: un inhibidor multi tirosina kinasas (BCR-ABL, C-KITr, PDGFrα y β)utilizado en el tratamiento de la Leucemia Mieloide Cronica, en el GIST, entre otros tumores; produce
Alteracion del metabolismo mineral y oseo
Adinamia osea: disminuyendo la formación y resorción osea
Hipofosfatemia con hiperfosfaturia, hipocalcemia, hiperparatiroidismo secundario
Estas alteraciones están relacionadas con la dosis de imatinib y se empeoran con la deficiencia de 25 OH vitamina D.
Fenomenos asociados a la osteoporosis en el contexto de cáncer
- La metastasis osea
- La hipercalcemia de malignidadMetastasis oseas
La incidencia exacta de las metastasis oseas es desconocida, pero se presenta en el 70% de pacientes con enfermedad avanzada de cáncer de próstata y mama; y en 15 – 30% de pacientes con carcinoma de pulmon, colon, estomago, vejiga, utero, recto, tiroides o riñon.
La enfermedad metastasica osea generalmente es incurable y está relacionada con la sobrevida
Entre las manifestaciones clinicas tenemos:
- Dolor oseo
- Fracturas patológicas relacionadas con la mala calidad osea
- Discapacidad
Las metástasis pueden ser:
- Liticas: la gammagrafia osea es normal
* Esta mediada por Proteina relacionada con parathormona (PTHrp), Interleukina-6, Factor de Necrosis Tumoral-a, Prostaglandina E2, Factor Estimulante de Colonia Monocito - Macrofago.
* La enfermedad caracteristica es el mieloma multiple- Blasticas
* Estan mediadas por endotelina 1 y otros factores locales dependiendo del tipo de tumor
* La enfermedad caracteristica es el Cancer de Prostata
* Entre el 15 – 20% de casos de cancer de mama tiene este tipo de metastasis- Mixtas.
Tratamiento de la enfermedad metastasica osea
Indicacion de tratamiento
- Disminución del dolor oseo
- Disminuir el riesgo de fracturas patológicas
- Inducir apoptosis de las células tumorales invasoras al hueso
Hipercalcemia de malignidad
Se presenta en el 20 – 30% de los pacientes con cáncer en algún momento de su enfermedad
Puede ser un evento terminal en el paciente con cáncer no endocrino; el 50% de los pacientes mueren durante los siguientes 30 dias.
Entre las manifestaciones podemos encontrar:
- Alteración mental progresiva
- Coma
- Falla renal
Clasificacion de la hipercalcemia
- Hipercalcemia Osteolitica local:
* Presencia de resorción osteoclastica incrementada alrededor de las células malignas
* corresponde al 20% de casos
* Se asocia con extensas metástasis
* Hay liberación de citoquinas, quemoquinas y pr-PTH
* Entre las enfermedades caracteristicas esta el cáncer de mama, mieloma y linfoma.
- Hipercalcemia humoral de malignidad:
* Hay escasas o minimas metástasis
* Secreción de proteína relacionada con pr-PTH
Incrementa la resorción osea
Incrementa la resorción renal de calcio
Hipofosfatemia Entre las enfermeades caracteristicas tenemos el Cancer de cabeza y cuello, esófago, cérvix, pulmon, renal, ovario, endometrio,mama y linfoma asociado a HTLV
o Puede tener secrecion 1,25 dihidroxivitamina D que se asocia a:
Resorcion osea incrementada Absorción intestinal de calcio y fosforo incrementada
Entre las enfermedades asociadas tenemos todos los tipos de linfoma
Corresponde a menos del 1% de casos* Otra causa menos frecuente es la secrecion de PTH por tumor no endocrino que cursa con
Hiperparatiroidismo ectópico
Incrementada resorción osea
Absorción intestinal de calcio incrementada
Hipofosfatemia
Los tumores pueden ser variables
Corresponde a menos del 1% de casos.
Tratamiento de la hipercalcemia maligna:
El tratamiento es escalonado
se debe definir el tratamiento adecuado de acuerdo al pronostico global del paciente
- Tratar en los posible la neoplasia maligna
- Suspender los suplementos que contengan calcio
- Retirar el litio, calcitriol, tiazidas
- Favorecer la movilización y claridad mental del paciente
o Retirar los sedantes
o Retirar si es posible los analgésicos
o Fomentar la deambulacion
- Corregir la hipofosfatemia, manteniendo el producto calcio X fosforo inferior a 30 en mg/dl de forma enteral si es posible
- Vigilar estrechamente los niveles de creatinina
- Hidratacion adecuada dependiendo de la función renal, el estado cardiovascular, el grado de alteración mental, la severidad de la hipercalcemia
* En hipercalcemia moderada a severa utilizar solución salina en infusión entre 200 – 500 ml/hora
- Promover la perdida renal de calcio* Infusión de solución salina
* Diuréticos de asa después de que el paciente este hidratado
Dosis 20 – 40 mg IV a necesidad
Vigilar los niveles de potasio
- Uso de bifosfonatos intravenosos
* Pamidronato en dosis de 60 – 90 mg IV diluido en 50 – 200 ml de SSN y pasar en 2 hrs
* Zoledronato en dosis de 4 mg diluido en 50 ml de SSN y pasar en 15 minutos
- Otras terapias
* Glucocorticoides
Prednisona 60 mg dia durante 10 dias
* Mitramicina, una dosis única IV de 25 mcg/kg de peso diluida en SSN y pasar en 4 – 6 hrs
* Calcitonina 4 – 8 UI/kg de peso IV o SC cada 12 horas
* Nitrato de Galio 100 – 200 mg/m2 de superficie corporal IV en infusión continua para 24 hrs durante 5 dias
- Dialisis con dialisado bajo en calcio o sin calcio, se indica cuando:
* El filtrado gomerular cae a 10 – 20 ml/min
* Hay insuficiencia cardiaca congestiva que contraindica la hidratación
- Futuras terapias basadas en la fisiopatologia del cancer, tenemos:
* Denosumab y otros anticuerpos monoclonales humanos contra RANKL
o Osteoprotegerina recombinante
o Inhibidores de catepsina K
Tratamiento de la osteoporosis
Ya despues de haber evaluado el paciente y las alteraciones asociadas con respecto al metabolismo del calcio y fosforo, procedemos a:
Recomendaciones generales
1. Ingesta de calcio 1200 – 1500 mg dia
2. Ingesta de vitamina D entre 400 – 800 UI dia dependiendo de la edad
3. Realizar ejercicio: aerobico y de resistencia
4. Suspender el cigarrillo
Definir el uso de Bifosfonatos: pamidronato, zoledronato, alendronato, risedronato o clodronato con el fin de
• Disminuir la resorción osea: incrementar la función del osteoblasto.
• Educar y estar atentos con respecto a la Toxicidad de los bifosfonatos
o Necrosis avascular de la mandibula
o Síndrome flu like en la aplicación IV
o Alteración de la función renal
o hipocalcemia.
Definir si esta indicado un modulador del receptor de estrógenos: raloxifeno, toremifeno.
Eventualmente el paciente puede requerir una terapia en fase II u off-label como
*Denosumab: anticuerpo monoclonal humano contra RANKL evaluado en
• Cáncer de próstata• Cáncer de mama.
Recomendaciones actuales para el diagnostico, seguimiento y tratamiento de la osteoporosis en el paciente oncologico
Basadas en el NCCN Task Force Report: Cuidado de la salud Osea en Cancer.
Realizado por : Oncologos clínicos de mama, ortopedia quirúrgica, endocrinologos, médicos nucleares, Oncologos clínicos genitourinarios
Tamizaje y detección de osteoporosis
- La definición del riesgo de fractura se hace a traves de:
* Densidad Mineral osea (DXA)
Utilizando el T- Score de cuello femoral que ha demostrado mayor sensibilidad
* La Edad
* El uso de Farmacos previos para proteger la masa osea
Fármacos antitumorales
• Falla ovárica asociada a quimioterapia
Otras medicaciones
* La Historia y presencia de fracturas vertebrales
Es el mejor predictor de una refractura
* Riesgo de caídas
* Niveles de Vitamina D
* Estimacion del riesgo de fractura por FRAX especifico de población y nación
T- Score de cuello femoral, edad, genero, talla, fractura previa, fractura parental de cadera, uso de glucocorticoides, artritis reumatoidea, osteoporosis secundaria (deficiencia de andrógenos/estrógenos), uso de alcohol
* Marcadores de recambio oseo* Menopausia inducida por quimioterapia o por ablación, uso de glucocorticoides, medicaciones que alteran las hormonas sexuales
Valorar los niveles de calcio y vitamina D Realizar una Densitometria osea DXA basal y cada 12 – 24 meses
- Plantear las opciones terapéuticas para osteoporosis
* Suplementos de calcio
Para mayores de 50 años: 1200 mg dia divididos
Para menores de 50 años: 1000 mg dia
Limite superior de formulacion de calcio esta entre 2000 – 2500 mg dia
* Suplementacion de Vitamina D
Correcion con 50000 UI semanal por 8 semanas
Mantenimiento de 800 – 1000 UI dia
* Modificaciones del estilo de vida
Ejercicio cardiovascular, balance, fuerza muscular
Evitar tabaco y limitar el alcohol
* Plantear tratamiento farmacologico
Antiresortivos
• Bifosfonatos – mas potentes
* Alendronato
* Risedronato
* Ibandronato
* Acido zoledronico
• Terapia hormonal y estrógenos
* Contraindicado en cáncer de mama
• SERMs
o Raloxifeno
No dar con Inhibidor de Aromatasa o Tamoxifeno
• Calcitonina – muy débil respuesta
• Inhibidor de Ligando RANK
* Denosumab – no aprobado
Anabolicos
• Teriparatide
* Contraindicado en historia de radioterapia
* No usar en historia de cancer.
Interrogantes y recomendaciones antes de formular una terapia para osteoporosis en cancer
1. Que factores de riesgo importantes debo recordar?
a. Fracturas previas
b. El deterioro de la masa osea medida por densitometría
c. Historia familiar de fractura de cadera por fragilidad
d. Uso de glucocorticoides
e. El numero de años en menopausia
f. El numero de dosis recibidas de análogos de GnRH
g. El uso de medicaciones para detener el deterioro oseo
2. Esta terapia formulada es costo-efectiva?
a. Previene el deterioro de la masa osea?
b. Previene fracturas?
c. Disminuye discapacidad por fractura?
d. Disminuye mortalidad por fractura?
3. Como se puede seleccionar la paciente optima para dicho tratamiento?
a. Cuando hay fractura por fragilidadb. Cuando hay criterios para osteoporosis
c. En baja masa osea individualizar la terapia
i. TS o ZS < -2,0 en paciente con inhibidores de aromatasa y/o supresión ovárica ii. Perdida del 10% de masa osea en el seguimiento densitometrico.
4. Cuando decido observar y retardar la terapia?
5. La perdida de masa osea es reversible?
6. La densitometría es la herramienta optima para predecir fracturas y realizar seguimiento?
7. Los marcadores de recambio oseo me ayudarían para definir terapia y realizar seguimiento?
8. Cuando debo realizar tamizaje con densitometría y con que intervalo?
a. Para mujeres con carcinoma de mama se recomienda realizar una Densitometria osea basal al inicio de la terapia supresora ovárica o al inicio de inhibidor de aromatosa con controles anuales
b. Para mujer premenopausica con falla ovárica inducida por quimioterapia. 9. Puedo sugerir una combinación o uso secuencial de dos medicamentos
a. Inhibidor de aromatasa y tamoxifeno?
i. NO es recomendado, basado en los efectos adversos evaluados en la combinación de tamoxifeno y anastrozole en el estudio Anastrozole and Tamoxifen, Alone and in Combination trial
b. El uso secuencial o concurrente de Tamoxifeno y Raloxifeno? i. NO es recomendado, basado en su mecanismo de acción y estudios que muestran que el Tamoxifeno puede estimular el crecimiento de células dependientes (de tamoxifeno).
10. Se puede utilizar una terapia anabólica para osteoporosis
a. El uso de Teriparatide esta prohibido por la FDA en pacientes con carcinoma de mama, historia previa de radiación osea, en presencia o historia de metástasis oseas
b. El uso de ranelato de estroncio, no tiene evidencia en osteoporosis en pacientes con carcinoma
Debilidades de la evidencia actual
- Los estudios están realizado principalmente en carcinoma de próstata y de mama
- Los desenlaces evaluados son densidad mineral osea- No tenemos gran evidencia en prevención de fracturas e impacto en mortalidad
- No tenemos evidencia del cual es el tiempo de tratamiento y la toxicidad de estos tratamientos
- La dosis optima en el contexto de osteoporosis y cáncer no se ha establecido.
Conclusiones
El paciente con cáncer tiene riesgo de perdida de masa osea por multiples factores, entre ellos se destaca el hipogonadismo, pero la desnutricion, el uso de corticoides, las citoquinas y otros factores liberados por el tumor conllevan a la perdida de masa osea.
Actualmente tenemos terapias con eficacia probada en la detención y estabilización de esta perdida de masa osea.
La terapia antiresortiva (bifosfonatos e inhibidores del ligando RANK) pueden mejorar y estabilizar la densidad mineral osea, pero no hay suficiente evidencia en la prevención de fracturas que es el desenlace clínico mas importante.
El tamoxifeno esta asociado con un modesto beneficio en la densidad mineral osea en mujer postmenopausica y produce una pequeña disminución en la densidad mineral osea en mujer premenopausica, pero no existe evidencia fuerte que estos cambios se relacionen directamente con fractura o incremento en el riesgo en la mujer con carcinoma de mama.
BIBLIOGRAFIA
Warming L. et al. Osteoporos Int. 2002;13: 105 – 112
Eastell R, et al. J Bone Miner Res. 2006; 21:1215 -1223
Shapiro CL, et al. J Clin Oncol. 2001; 19:3306 - 3311
Kyle RA and Rajkumar V. Multiple Myeloma. N Engl J Med 2004;351:1860-73
Glass, DA, Patel MS, and Karsenty G. A New Insight into the Formation of Osteolytic Lesions in Multiple Myeloma. NEJM 349;26 December 25, 2003
Carpenter TO. Oncogenic Osteomalacia – A complex dance of factors. n engl j med 348;17; april 24, 2003
Fogelman I, et al.Osteoporos Int. 2003; 14:1001 - 1006
Shahinian V. et al. Risk of Fracture after Androgen Deprivation for Prostate Cancer. N Engl J Med 2005;352:154-64.
Stewart, AF. Hypercalcemia Associated with Cancer. N Engl J Med 2005;352:373-9
Gralow JR. Bone Density in Breast Cancer: When to Intervene? J Clin Oncol 25(22): 3194-3197, 2007
Saad F et al. Cancer Treatment–Induced Bone Loss in Breast and Prostate Cancer. J Clin Oncol 26:5465-5476
Brown SA and Guise TA. Cancer treatment-related bone disease. Crit Rev Eukaryot Gene Expr. 2009 ; 19(1): 47–60.
NCCN Task Force Report: Bone Health in Cancer Care. A presentation from the NCCN 14th Annual Conference: Clinical Practice Guidelines & Quality Cancer Care held in Hollywood, Florida, USA









No hay comentarios:
Publicar un comentario