JUAN SEBASTIAN RAMÍREZ LEÓN
Médico Interno Universidad de los Andes Colombia
MYRIAM
LUCÍA RODRIGUEZ N
MD internista hematóloga
FSFB Universidad de los Andes
DEYANIRA GONZÁLEZ DEVIA
MD internista endocrinóloga
FSFB Universidad de los Andes
INTRODUCCIÓN
Los anticoagulantes son medicamentos ampliamente utilizados en la
práctica hospitalaria y ambulatoria en forma temporal o crónica en sujetos con
riesgo moderado a elevado de fenómenos trombóticos. Sus eventos adversos más
reconocidos son los hemorrágicos y/o hematológicos; sin embargo, el impacto
sobre el hueso es poco conocido .
En Colombia tenemos disponible Heparina no fraccionada (HNF), Heparinas
de Bajo Peso Molecular (HBPM) y anticoagulantes orales como warfarina y los de denominados
nuevos anticoagulantes orales (dabigatran, ribaroxavan, apixaban etc.). La
mayoría de los estudios se centran en la HFN; sin embargo, nos referiremos
brevemente a este medicamento ya que su
uso cada vez menos frecuente en la práctica clínica.
ANTICOAGULANTES INYECTABLES:
Heparinas de Bajo Peso Molecular (HBPM): Son derivados de la HNF; al igual que esta, producen su efecto
anticoagulante catalizando la inhibición de los factores de la coagulación
mediada por la antitrombina. Tienen menor afinidad por las células y las
proteínas en el torrente sanguíneo lo cual explica las ventajas y diferencias
en su acción anticoagulante, farmacocinética y efectos adversos con respecto a
su molécula madre [1]. Se usan en la actualidad para la prevención y el
tratamiento de la trombosis venosa profunda (TVP), prevención del embolismo
sistémico en sujetos con válvulas mecánicas y prevención de la perdida de la
gestación en mujeres con síndrome antifosfolípido. Adicionalmente se usan en
hombres y en mujeres no gestantes quienes han presentado trombosis venosa
recurrente a pesar del manejo con anticoagulantes orales, en personas con
inmovilizaciones prolongadas que requieren tromboprofilaxis y adicionalmente, en
sujetos con infarto agudo al miocardio (IAM) sin elevación del segmento ST [1,2]. Las
HBPM presentan un riesgo de sangrado mucho menor que la HNF, además de otros efectos indeseados como la trombocitopenia.
Sin embargo, no se conoce con certeza su relación con la osteoporosis, debido a
que en los diferentes estudios se muestran resultados contradictorios.
La inquietud sobre la magnitud del efecto de las HBPM en el metabolismo
óseo surge inicialmente debido a que la osteoporosis es un efecto adverso
relativamente conocido de la HNF
[3]. Múltiples estudios, en su mayoría llevados a cabo en la década de los
noventa, relacionan el uso prolongado de HNF en mujeres gestantes con una
disminución en la Densidad Mineral Ósea (DMO) y un aumento en el riesgo de
fracturas osteoporóticas que varían de manera importante entre las distintas
series (2.2% - 36%) sin una causa claramente establecida [5,6].
Estudios preclínicos
Los modelos animales hasta el momento han sido una herramienta clave
para dilucidar el efecto de los medicamentos anticoagulantes sobre el metabolismo y la formación del hueso
debido a que es posible hacer mediciones directas comparando su efecto sobre la
función celular de osteoclastos y osteoblastos; sin embargo tienen limitantes debido
a que las mediciones son secundarias, como la osteodensitometría (ODMO) que
mide la densidad mineral del hueso que para un ser humano requieren periodos de
estudio mucho más prolongados que permitan evaluar y documentar
los cambios o comparar el riesgo de
fracturas; de la misma manera se requieren poblaciones extensas y diversas por las diferencias raciales del riesgo de fractura.
Un estudio en ratones comparó el efecto de la HNF con una HBPM
(Tinzaparina) en el hueso; los ratones que recibieron las administración de ambos medicamentos presentaban disminución
significativa en los niveles de fosfatasa alcalina, que es un marcador de
formación ósea, mientras que las ratones tratados con HNF mostraron un aumento
en los niveles de piridolina urinaria, el cual funciona como un un marcador de resorción. También se observó a
través de un análisis histomorfométrico que todos los ratones en tratamiento
anticoagulante presentaban disminución de la superficie osteoblástica en
proporciones similares. Sin embargo, únicamente aquellos que recibieron HNF
mostraron un aumento en la superficie de los osteoclastos. Estos hallazgos
sugieren que la HNF produce pérdida de la masa ósea aumentando la resorción y
disminuyendo la formación, mientras que las HBPM van a producir una osteopenia
menos marcada al no tener ningún efecto sobre la resorción del hueso [7]. Se ha
demostrado que la HNF estimula la resorción del hueso al unirse a la osteoprotegerina
e impedir su unión e inhibición del RANKL el cual estimula la función de los
osteoclastos en la superficie del hueso [8]. En humanos la HNF aumenta la
movilización y los niveles de Osteoprotegerina en sangre en comparación con una
HBPM, lo cual índica que tiene una mayor afinidad hacia esta molécula [9].
Estos hallazgos explicarían en parte el efecto más profundo de la HNF sobre la
pérdida de hueso; sin embargo no se conoce con claridad como actúa y logra
inhibir la función de los osteoblastos donde podría compartir el mismo
mecanismo de acción con las HBPM. Se ha visto que tanto la HNF como las HBPM
tienen un efecto negativo en la proliferación de los osteoblastos, sin
observarse una diferencia significativa entre los diferentes medicamentos que
hacen parte de este grupo (Certoparina, Enoxaparina, Nadroparina, Dalteparina)
cuando se adicionan a un cultivo de osteoblastos humanos [10].
FIGURA 1.
Efecto de la Heparina No Fraccionada (HNF) y la Heparina de Bajo Peso
Molecular (HBPM) tinzaparina, sobre el porcentaje de superficie ocupado por
osteoblastos (figura izquierda) y osteoclastos (figura derecha). Las ratas fueron inyectadas con HNF o con
HBPM. Los datos son expresado como
promedios +/- desviaciones estándar. En la figura
izquierda el valor P fue similar comparado con la línea de base y sus
controles. En la figura derecha el Valor
ₐP fue comparado con la línea de base y controles; y el valor bP fue comparado
con los valores obtenidos de las ratas tratadas con HBPM. Tomado de Muir JM et
al. Blood 1997; 99(9) mayo 1: pp3236-3242
En otro estudio llevado en ratones, se comparó el efecto de la HNF con
otra HBPM (Dalteparina) sobre la diferenciación de células mesénquimales hacia
osteoblastos o adipocitos. Se encontró que ambos medicamentos disminuían el
porcentaje de osteoblastos diferenciados (productores de fosfatasa alcalina)
pero eran necesarias concentraciones cuatro veces mayores de HBPM para alcanzar
un efecto equivalente al observado con la HNF. Adicionalmente se observó que
había un aumento en la diferenciación de las células mesénquimales a adipocitos
y que eran necesarias concentraciones ocho veces mayores de HBPM para alcanzar
un efecto equivalente al de la HNF. Para confirmar este efecto se midió la
expresión de dos factores de transcripción claves en la diferenciación de los
osteoblastos (Cbfa1 y Osterix) y se observó que en los cultivos celulares
tratados con HNF había una disminución significativa. Adicionalmente se
encontró un aumento del marcador específico de adipocitos, PPAR-y [11]. Estos
hallazgos nos permiten concluir que tanto la HNF como las HBPM tienen un efecto
deletéreo sobre la formación del hueso que es más marcado en el caso de la HNF
al inhibir con más potencia la diferenciación de los osteoblastos y
adicionalmente al aumentar la resorción del hueso.
Se han realizado investigaciones in vitro comparando el efecto de las
HBPM y otros medicamentos anticoagulantes en el metabolismo óseo. Un estudio in
vitro compara el efecto de la Dalteparina con un inhibidor directo del Factor X
(Fondaparinux) en diferentes concentraciones sobre osteoblastos humanos en un
periodo de 7 días. Se encontró que la Dalteparina en cualquier concentración
causaba disminución en la síntesis de proteínas. Adicionalmente los
osteoblastos cultivados con Dalteparina a concentraciones de 300 a 900 mg/dl
presentaban disminución en la expresión génica de Fosfatasa Alcalina y
Osteocalcina. Estos efectos inhibitorios no fueron observados con el
Fondaparinux. Ninguno de los dos compuestos alteró la proliferación celular de
los osteoblastos. (12)
Otro estudio ha comparado el efecto del Fondaparinux con HNF,
Dalteparina y Enoxaparina en diferentes concentraciones, sobre la función de
osteoblastos obtenidos en sujetos de ambos géneros sometidos a reemplazo de
rodilla por gonartrosis en quienes se había descartado inicialmente desordenes
en el metabolismo del hueso u osteoporosis. En este estudio no se observó un
efecto citotóxico directo de ninguna de estas sustancias sobre los
osteoblastos; sin embargo, se observa una disminución estadísticamente
significativa del contenido de ADN y función mitocondrial en cultivos celulares
tratados con Heparinas en rango terapéutico. La HNF en concentraciones
terapéuticas producía disminución en la síntesis de proteínas que no se observó
con las otras Heparinas. Se observó
adicionalmente que los osteoblastos cultivados con Fondaparinux tenían una
capacidad 1.7 veces mayor de fijar el Calcio en la matriz del hueso comparado
con los otros grupos, efecto que permanecía aún en rangos terapéuticos aunque
con menor potencia. Los osteoblastos tratados con Fondaparinux producen el
doble de colágeno tipo I en comparación con los otros cultivos a una
concentración supraterapéutica de 100 UI/ml. A diferencia del estudio
mencionado anteriormente, ninguna de las sustancias investigadas resultó
influir en la expresión de la Fosfatasa Alcalina [13]. En este estudio no se
tuvo en cuenta ningún cultivo de control que no estuviera bajo la influencia de
estos compuestos, por lo tanto no se puede tener una idea clara sobre la
magnitud del efecto que tiene el Fondaparinux sobre la función del osteoblasto.
Sin embargo, las Heparinas mostraron un efecto inhibitorio en la formación ósea en
concentraciones incluso terapéuticas, evidenciado en la disminución sobre la
calcificación de la matriz ósea y en los niveles de colágeno tipo I.
No solamente se ha estudiado el efecto directo sobre la función de los
osteoblastos del Fondaparinux en comparación con otras Heparinas. Un estudio
más reciente compara el efecto del Fondaparinux con una HBPM (Tinzaparina)
sobre la diferenciación de células madre mesénquimales. Se evidenció que la
Tinzaparina tenía un efecto negativo sobre la proliferación de estas células,
efecto que no estaba presente en los cultivos tratadados con Fondaparinux. Sin
embargo, no se encontró un efecto deletéreo de estos dos compuestos sobre la
diferenciación osteogénica o condrogénica de las células madre mesénquimales
[14]. La diferenciación de las células madre mesénquimales es importante para
la reparación de las fracturas sugiriendo que el Fondaparinux no tiene efectos
negativos sobre la consolidación del hueso, por lo menos en modelos in vitro.
Otro estudio comparó el efecto de la HNF y una HBPM (Dalteparina) con un
nuevo inhibidor directo de la trombina, Melagatrán, en osteoblastos humanos. Se
evidenció que el Melagatrán tiene un efecto inhibitorio mucho menos marcado
sobre la proliferación y la síntesis proteica de los osteoblastos en
comparación con los otros dos compuestos [15].
Estudios clínicos
El efecto de las HBPM sobre el metabolismo óseo y el riesgo de
desarrollar osteoporosis, se ha estudiado principalmente en mujeres gestantes
con anticoagulación crónica [3]. Los estudios clínicos no han logrado demostrar
o cuantificar un efecto claro de estas moléculas; sin embargo, existe cada vez
más evidencia de sus efectos sobre el metabolismo óseo a nivel molecular. Un
metaanálisis reciente no encontró evidencia de una diferencia clínicamente
significativa entre el uso de HNF y HBPM con respecto a la aparición de
osteoporosis [4]. Los estudios en humanos han arrojado resultados
contradictorios con respecto al uso de HBPM, sin embargo parece que existe una
ventaja de este grupo de medicamentos frente al uso de HNF en lo que respecta a
la salud del hueso y la pérdida de masa ósea.
En un estudio con 98 gestantes que requerían tromboprofilaxis,
comparando la HNF con Enoxaparina y su posible efecto sobre la DMO en el
transcurso de la gestación no se encontró diferencia en la DMO del cuello
femoral o la DMO total del fémur proximal entre ambos grupos de intervención.
Se encontró una incidencia de pérdida significativa de la DMO (>10%) del
cuello femoral en el 2.4% de las mujeres en el grupo de la HNF y 2% en el grupo
de la Enoxaparina [18]. Otro estudio comparó el uso de Dalteparina con HNF en
gestantes con TVP confirmada, previa o en curso. Se encontró una disminución
estadísticamente significativa de la DMO de la columna lumbar en el grupo de
HNF comparado con el grupo de Dalteparina y el grupo control. No se encontró
diferencia significativa entre estos dos últimos grupos. Los autores concluyen
que es seguro usar Dalteparina en gestantes que requieran terapia
anticoagulante [19]. Dos estudios recientes realizados en gestantes que
requerían terapia crónica con HBPM no encontraron una relación con pérdida
significativa de la masa ósea [20,21]. Se ha encontrado que gestantes con uso
de enoxaparina presentan una disminución en el porcentaje de fosfatasa alcalina
específica del hueso sobre la fosfatasa alcalina total, lo cual sugiere una
disminución en la formación de hueso en este periodo. No se encontró ninguna
diferencia en los niveles de RANKL y Osteoprotegerina entre el grupo de
tratamiento y el grupo de control. No se midió la DMO ni se reportó un aumento
en el riesgo de fracturas osteoporóticas [22]. Las poblaciones estudiadas son
muy pequeñas y los periodos son cortos ya que la mayoría de estudios se han
hecho en mujeres gestantes. Es importante aclarar que son mujeres jóvenes en
edad reproductiva que probablemente tendrían gestaciones en un futuro donde nuevamente
requerirían tratamiento anticoagulante adicional. No se conoce con certeza si
el tratamiento crónico con HBPM pueda tener efecto sobre el pico de ganancia de
masa ósea en jóvenes y que esto pueda repercutir en el futuro en el desarrollo
de osteoporosis.
Los estudios en no gestantes con uso crónico de HBPM y su efecto sobre
el hueso son limitados ya que el uso crónico de este grupo de medicamentos está
restringido y su indicación más común es tromboprofilaxis durante la gestación.
Un grupo de 86 sujetos de ambos géneros fueron asignados a tromboprofilaxis
secundaria posterior a un evento de TVP con Nadroparina, Enoxaparina y
Acenocumarol. Se comparó la DMO en fémur y columna lumbar (L2-L4) en diferentes
momentos durante el tratamiento. Se encontró una disminución en la DMO en los
sujetos tratados con HBPM y acenocumarol, sin embargo la disminución fue mucho
menor con este último medicamento. Se encontró una diferencia en la DMO
estadísticamente significativa entre los grupos tratados con Enoxaparina y
Acenocumarol (p< 0.005 [23].
El uso crónico de este grupo de medicamentos en pacientes no gestantes se
indica principalmente en ancianos, sujetos oncológicos, hipersensibilidad a
cumarínicos o imposibilidad de realizar un seguimiento de los tiempos de
coagulación requerido. Sin embargo con el advenimiento de nuevas terapias
orales, su uso probablemente estará más relegado en un futuro.
ANTICOAGULANTES ORALES:
Antagonistas de la Vitamina K: Por mucho tiempo fueron los
únicos medicamentos orales usados en anticoagulación. Actúa inhibiendo la
interconversión cíclica de la Vitamina K y su epóxido. Por lo tanto interfieren
en la gama carboxilación de los residuos de glutamato en la región N-terminal
de las proteínas dependientes de Vitamina K.
Hay varios factores de la coagulación que dependen de la Vitamina K para
adoptar su forma activa (Factor II, VII, IX y X). Adicionalmente la Vitamina K
se encarga de la gama carboxilación de las proteínas C, S y Z que tienen un rol
anticoagulante. Por esta razón los antagonistas de la Vitamina K pueden tener
un efecto procoagulante antes que la inhibición de los factores de la
coagulación alcance un nivel terapéutico. El efecto anticoagulante de los Antagonistas
de la Vitamina K se puede monitorizar con la medición del Tiempo de Protrombina
(PT) y el INR (International Normalized Ratio) que es la relación entre el PT
del paciente y el PT control del laboratorio [24].
La Osteocalcina es una proteína específica del hueso producida por los
osteoblastos. La Vitamina K tiene un rol importante dentro del metabolismo óseo
al permitir la carboxilación de tres residuos de glutamato de la Osteocalcina,
proceso indispensable para la integración de esta proteína dentro de la matriz
extracelular del hueso al facilitar su unión con la Hidroxiapatita. Los
Antagonistas de la Vitamina K inhiben esta reacción. Un estudio realizado en
ratas comparó el efecto de la Warfarina con el Edoxaban (Inhibidor directo del
Factor X) sobre el metabolismo de la Osteocalcina. Se midieron entonces los
niveles séricos de la Osteocalcina activa (Gamma carboxilada) y de la
Osteocalcina no Carboxilada. En el caso de la Warfarina, una dosis terapéutica
de 1mg/kg fue suficiente para incrementar significativamente los niveles de
Osteocalcina no Carboxilada y aumentar ligeramente los niveles de Osteocalcina
total. El Edoxaban a su vez, no tuvo ningún efecto sobre esta a niveles
terapéuticos o supraterapéuticos [25]. Este estudio confirma el rol de los
Antagonistas de la Vitamina K dentro del metabolismo del hueso y explica, al
menos en parte, la perdida ósea asociada a su uso prolongado.
Los osteoblastos dependen para su diferenciación de la señalización
mediada por uniones Gap intercelulares. Se ha demostrado que la Warfarina
inhibe la comunicación por uniones Gap por una vía independiente de Kinasas
[26]. Se realizó un estudio donde se comparó el efecto de la Warfarina con el
ácido 18-alfa-glicirretínico, derivado de la raíz de licorice, conocido inhibidor
reversible de la comunicación por uniones Gap, sobre la diferenciación de los
osteoblastos en un modelo in vitro. Se evidenció que ambos compuestos inhiben
la diferenciación osteoblástica inhibiendo la expresión de marcadores
osteogénicos específicos (Fosfatasa Alcalina, Colágeno tipo I alfa 1,
Osteocalcina y Osterix) inducida por la Proteina Morfogenética del Hueso tipo 2
(BMP-2); y además, ambos compuestos inhiben la actividad del
factor de transcripción Run-X2, el cual regula múltiples genes que intervienen
en la formación del hueso [27]. En la actualidad no se conoce los mecanismo
moleculares por los cuales se da la inhibición mediada por Warfarina sobre las
uniones Gap; sin embargo este estudio deja ver el rol inhibitorio que tiene
sobre la diferenciación de los osteoblastos, necesaria para la formación y
reparación del hueso.
Estudios preclínicos
Un estudio realizado en macacos Rhesus machos encontró que
el uso prolongado de Warfarina no producía alteraciones en la DMO a pesar que
aumentaba los niveles de Osteocalcina no carboxilada como se espera por su
mecanismo de acción; otros marcadores séricos como la Fosfatasa Alcalina,
Calcio sérico, Calcio Urinario y Osteocalcina carboxilada no fueron alterados
por el uso de Warfarina. Los macacos recibían un aporte de Calcio y Vitamina D
que superaba los requerimientos diarios [28]. Estos hallazgos sugieren que el
uso de Warfarina no se asocia a pérdida o alteración en el metabolismo del
hueso. Los autores sugieren que los hallazgos que soportan la asociación entre
el uso de Antagonistas de Vitamina K y osteoporosis en humanos se
relacionan más a las comorbilidades de los sujetos en terapia anticoagulante,
que en muchas ocasiones disminuyen significativamente su movilidad lo cual es
factor de riesgo intrínseco para pérdida de la masa ósea.
A diferencia de los hallazgos ya descritos, encontramos un estudio
realizado en ratas que resulta ser novedoso ya que evaluó la calidad del hueso
con un análisis biomecánico e histomorfométrico. Un grupo de ratas recibió
Warfarina sódica a una dosis de 0,25 mg/kg, otro recibió 0,2mg/kg y un tercer
grupo sirvió como control recibiendo en el mismo periodo de tiempo solución
salina. Se vio una reducción estadísticamente significativa en los parámetros
biomecánicos de las ratas tratadas con Warfarina con una disminución de un 7.8%
en la carga máxima tolerada por el fémur en comparación con el grupo control.
Las ratas que recibieron Warfarina 0,25 mg/kg sufrieron una perdida progresiva
en el volumen de hueso esponjoso hasta llegar a una diferencia promedio de
17.4% + 7.6% después de un mes de tratamiento en comparación con el
grupo control. Se observó también una disminución del 63.6 + 6.7% en la
superficie osteoblástica y un 83.5 + 7.4% de la superficie osteoide en
comparación con el grupo de control, mientras que la superficie osteoclástica
aumentó 34.6 + 14% [29]27. Estos hallazgos afirman el efecto deletéreo
de la Warfarina sobre el hueso y no pueden ser explicados completamente por la
inhibición en la gama carboxilación de las proteínas Gla. Se ha propuesto que
la Vitamina K tiene un efecto inhibitorio directo sobre los osteoclastos que
puede contribuir a estos cambios. Además se ha visto que la Warfarina puede
tener un efecto inihibitorio sobre la comunicación mediada por uniones Gap en
Osteoblastos, que interviene en su maduración [26]. Los autores hacen énfasis
además en que las ratas tienen una tasa de recambio óseo mucho más acelerada
que los seres humanos. Por esta razón un tratamiento de tan solo 28 días logró
ocasionar cambios significativos en los huesos, mientras que en población
humana se requerirían periodos mucho más prolongados para observar los mismos
cambios. Por esta razón hay estudios en humanos donde se evidencian cambios
óseos relacionados a la anticoagulación mientras otros no observan esta
relación.
Estudios clinicos
A pesar de la plausibilidad biológica, no hay resultados concluyentes en
la literatura que soporten o rechacen un efecto deletéreo sobre el hueso relacionado
al uso de Antagonistas de la Vitamina K. Los estudios en humanos que evalúan
los efectos de estos medicamentos sobre la masa ósea se remontan a mediados de
los noventa. Un estudio mencionado
previamente que compara el efecto de la terapia anticoagulante crónica con
Acenocumarol y HBPM, concluye que el efecto sobre el hueso secundario al uso de
Acenocumarol es menor en comparación con la Warfarina, sin embargo se encuentra
una disminución en la densidad mineral ósea del fémur en todos los casos, que
aumentaba con la duración del tratamiento [11].
Un estudio de corte transversal compara un grupo de varones con uso
crónico de Acenocoumarol (terapia mayor a 1 año) secundario a patología
cardiovascular (Cirugía cardiaca, fibrilación auricular (FA) e IAM) con un grupo control de sujetos sanos. El tiempo promedio de terapia
anticoagulante en estos pacientes fue 6 + 6.4 años. Se les realizó
ultrasonido cuantitativo de la metáfisis distal de la falange proximal y ODMO
en hueso calcáneo y en antebrazo distal a todos los sujetos sin encontrarse
ninguna diferencia significativa entre los dos grupos. Sin embargo los valores
de Fosfatasa Alcalina y C-telopéptido fueron menores en el grupo en tratamiento
indicando una disminución en la formación y resorción del hueso. Los autores
plantean que a pesar de la falta de evidencia radiológica de alteración en la
masa ósea, las alteraciones bioquímicas per sé pueden aumentar el riesgo de
fracturas [28]. Este estudio no evaluó la DMO en la cadera y la columna que son
medidas más usadas en estudios de osteoporosis. Además se tiene en cuenta
únicamente una población masculina en un rango de edad alrededor de los 50
años, relativamente sanos, que representan un grupo con bajo riesgo para el
desarrollo de osteoporosis. Es importante resaltar que no se evalúa el riesgo de
fracturas en estos sujetos. Los hallazgos aquí expuestos están de acuerdo con
otros estudios que no encuentran alteraciones radiológicas relacionadas a el
uso crónico de Warfarina.
Un estudio en niños evaluó el efecto de la terapia anticoagulante con
Warfarina en la DMO medida en columna lumbar. Todos los niños requerían
anticoagulación por patología cardiaca congénita compleja y habían recibido
tratamiento por un periodo mayor a 12 meses. La edad promedio era de 14.7 años
y el periodo de tratamiento promedio era 8.2 años. Se encontró que la DMO
aparente (g/cm3) era significativamente menor (p < 0.001) en los niños
anticoagulados (0.101) en comparación con los controles sanos (0.116) [30]. En
estos niños, la disminución en la DMO puede ser multifactorial y en el estudio
no se hizo un análisis ajustado con otros factores de riesgo concomitantes, por
lo tanto la validez de sus conclusiones es muy limitada.
FIGURA 2.
Efecto de la warfarina en la DMO aparente en niños con cardiopatía
cianótica (14) y no cianótica (3); quienes comenzaron a una edad promedio de
6,8 años (0,3 14,8) y la duración
promedio de tratamiento fue de 8,2 años (1 – 14 años). Tomado de Barnes C et al. Pediatr Res 2005;
57(4): 578-581.
Otro estudio tomaron 82 sujetos con EPOC y se buscaron predictores de Osteoporosis
y fracturas vertebrales. Se encontraron fracturas vertebrales en 29 de los sujetos,
en los cuales se observó una relación estadísticamente significativa con el uso
de Warfarina o Corticoesteroides por análisis de regresión logística univariado
(OR 4.57) y multivariado (OR 6.0). En 10
sujetos se encontraron 2 o más fracturas vertebrales capaces de alterar la
función pulmonar y se evidenció también una relación con el uso de Warfarina o
Corticoesteroides por análisis de regresión logística univariado (OR 5.7) y
multivariado (OR 11.4). En este estudio
además se encontró una relación entre la aparición de fracturas vertebrales con
la severidad del EPOC por disminución en el FEV1 y el uso crónico de oxígeno
[31]. Los autores no realizan ninguna recomendación relacionada al uso crónico
de Warfarina y la necesidad de encontrar alternativas en anticoagulación para
evitar el riesgo incrementado de fracturas en este grupo.
Otro estudio retrospectivo multicéntrico evaluó el riesgo de fracturas
osteoporóticas en sujetos con FA que se encontraban en
tratamiento crónico con Warfarina. Se encontró un aumento estadísticamente
significativo en el riesgo de fracturas osteoporótica en el grupo que usó
Warfarina mayor a 1 año (OR, 1.25). No se
encontró asociación en sujetos con terapia menor a 1 año. Cuando se ajustaba
con las variables de confusión y se estratificaba según la presencia de
osteoporosis(16.7%), persistía la relación entre la terapia anticoagulante y
las fracturas osteoporóticas (OR 1.32). Se evidenció una diferencia relacionada
al género. En hombres se incrementó el riesgo de fracturas osteoporóticas (OR,
1.63) mientras que en mujeres esta diferencia no fue estadísticamente
significativa (OR, 1.05). El riesgo de fracturas fue significativo en vertebras
(OR 1.7) y costillas (1.3) mas no en cadera y muñecas [32]. La diferencia
encontrada entre hombres y mujeres puede ser explicada porque las mujeres tienen
factores de riesgo adicionales para el desarrollo de osteoporosis como la
menopausia, lo cual puede opacar el efecto del tratamiento anticoagulante. Es
notable además que el riesgo de fracturas aumenta en el esqueleto axial más que
en el esqueleto apendicular. Esto puede ser explicado si se tiene en cuenta que
el esqueleto axial tiene una tasa de recambio mayor que el esqueleto
apendicular. Es decir que va a requerir con más frecuencia incorporar
Osteocalcina carboxilada en su matriz mineral. Si se inhibe la carboxilación de
la Osteocalcina con el uso de antagonistas de la vitamina K, estos sitios de
recambio rápido se verán depletados de este proteína rápidamente [29].
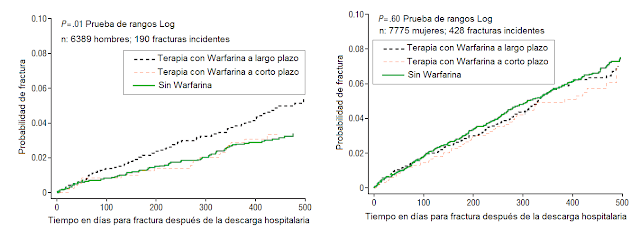
FIGURA 3. Tiempo para presentar una fractura
osteoporótica en sujetos bajo tratamiento de Warfarina sin previas fracturas.
Gage et al. Arch Intern Med. 2006;166:241-246
NUEVOS ANTICOAGULANTES ORALES
En Colombia tenemos varios anticoagulantes
orales diferentes a la warfarina, pero solo el rivaroxaban tiene literatura
publicada sobre sus efectos en hueso a nivel preclínico hasta la fecha.
Rivaroxaban: Es
un nuevo anticoagulante oral, inhibidor directo del Factor Xa. Comparando con
las HBPM, el Rivaroxaban no necesita la antitrombina como cofactor para actuar.
Adicionalmente se puede utilizar para evitar la aparición de trombocitopenia
inducida por heparinas [33].
El Rivaroxaban ha sido investigado en cultivos de osteoblastos humanos, mostrando
una inhibición en su proliferación, disminuyendo la actividad de la fosfatasa
alcalina y la síntesis de ADN en concentraciones terapéuticas; y probablemente esta
inhibición osteoblástica sea mediada por la producción de 12- y 15- ácido
hidroxieicosatetranoico. No se encontró una inhibición en la mineralización
celular [34] como se observó en los resultados descritos previamente [16] donde
el Rivaroxaban inhibió la expresión de proteínas implicadas en la
mineralización; aunque esta no se midió directamente. Esta situación puede
explicarse por la diferencia de los cultivos celulares; en el estudio previo se
utilizaron osteoblastos humanos primarios que podían contener células en
diferentes momentos de diferenciación, en las cuales el Rivaroxaban podía
actuar inhibiendo su proliferación, antes que pudieran alcanzar la madurez
necesaria para producir nódulos de mineralización.
Otro estudio realizado por el mismo grupo evaluó el efecto del Rivaroxaban
sobre la modulación fisiológica inducida por hormonas en cultivos de
osteoblastos humanos. Se evidenció que la adición de Rivaroxaban a los cultivos
celulares inhibía el estímulo producido por estrógenos, PTH y compuestos de la
Vitamina D sobre la actividad de la Creatin Kinasa, la síntesis de ADN y la
actividad de la Fosfatasa Alcalina en los cultivos de osteoblastos. Se observó
además que el Rivaroxaban no inhibe la expresión de receptores de estrógenos
alfa y beta ni de la 25-hidroxi-Vitamina D3- 1alfa- hidroxilasa, sin embargo si
inhibe el estímulo hormonal administrado [34]. Este hallazgo tiene
implicaciones importantes en cuanto el tratamiento con Rivaroxaban, además de
tener un efecto deletéreo inherente en la función de los osteoblastos,
interfiere adicionalmente en el mecanismo de acción de muchos de los
tratamientos disponibles para prevenir y tratar la osteoporosis.
FIGURA 4. Efecto de la enoxaparina y el
rivaroxaban sobre la función de los osteoblastos humanos. Los cultivos con osteoblastos humanos fueron
tratados con concentraciones variadas de de enoxaparina y rivaroxaban por 7
dias y luego se analizó la actividad de la fosfatasa alcalina. La actividad de la fosfatasa alcalina en los
cultivos tratados se expresó como un porcentaje de los controles no tratados. Los datos están presentados como promedios ± con desviación estándar con valor *p < 0.05; y valor **p < 0.01 utilizando
la prueba t-student (n:6). Modificado de
Solayar et al. BMC Musculoskeletal Disorders 2011, 12:247
Otro estudio in vitro realizado en
osteoblastos obtenidos en una biopsia de hueso de una mujer caucásica sometida
a un reemplazo de rodilla, comparó el efecto del Rivaroxaban con la
Enoxaparina. No se evidenció efecto negativa en las dos moléculas sobre la
viabilidad de los osteoblastos, lo cual se ha observado anteriormente. Sin
embargo, se midió la función de los osteoblastos con la actividad de la
fosfatasa alcalina. El Rivaroxaban disminuye de manera significativa la función
de los osteoblastos en cualquier concentración y tiene un efecto negativo más
importante que la enoxaparina en concentraciones terapéuticas. Así también
tiene un efecto negativo significativo sobre la expresión del ARNm de
Osteocalcina, mientras que en los cultivos celulares tratados con enoxaparina
se vio una disminución mucho menos significativa. El Rivaroxaban disminuye la
expresión de ARNm del factor de transcripción Runx2 y el factor osteogénico
BMP-2 [16]. En el pasado se encontró en modelos in vitro que las HBPM inhiben
la expresión del factor de transcripción Runx2 y el factor osteogénico BMP-2
[17].
CONCLUSIONES:
El efecto de los medicamentos anticoagulantes usados en la practica
clínica sobre el metabolismo óseo y el riesgo de desarrollar osteoporosis
todavía no ha sido bien dilucidado. El perfil de seguridad del tratamiento
anticoagulante cada día es más tolerable; y teniendo en cuenta además el
aumento en la expectativa de vida, podemos deducir que en un futuro los
periodos de tratamiento serán más prolongados en pacientes con patologías
crónicas.
Los estudios preclínicos sugieren que puede
existir un mayor riesgo de osteoporosis con el uso de HNF comparado con el uso
de HBPM. Sin embargo, entre las HBPM pueden existir diferencias y fondaparinux
parece tener menos efectos deletéreos en el hueso.
El no conocer con certeza los mecanismos fisiopatológicos relacionados
con la osteoporosis inducida por anticoagulantes; tampoco se puede suponer que
este efecto secundario pueda desaparecer con la aparición de nuevos
anticoagulantes. De hecho hay evidencia creciente que indica, al menos en
modelos in vitro, que algunos de estos nuevos medicamentos como el Rivaroxaban
alcanzan y hasta superan los efectos
deletéreos observados sobre cultivos de osteoblastos con el uso de otros
compuestos antiguos como HBPM.
Se deben realizar estudios poblacionales con el poder estadístico suficiente
para definir poblaciones en riesgo que requieran medidas de intervención para
evitar la pérdida de masa ósea secundaria a anticoagulación crónica y evitar la
aparición de osteoporosis. La osteoporosis tiene una etiología multifactorial
donde la edad, las mujeres con pérdida del influjo estrogénico posterior a la
menopausia y las comorbilidades serían variables determinantes en estos
estudios. Por lo tanto para definir un verdadero perfil de seguridad en
relación a la anticoagulación crónica serían necesarios estudios prospectivos a
largo plazo evaluando la osteoporosis y el riesgo de fracturas como desenlaces tardíos. Adicionalmente, se
requieren estudios sobre el impacto de la anticoagulación y la masa ósea fetal
y el crecimiento.
RECOMENDACIONES:
Se propone que todos los sujetos que requieran terapia crónica con
anticoagulantes orales o subcutáneos se les realice una evaluación del riesgo
de fractura, corrección de factores de riesgo para deterioro de la masa ósea y se
les debe dar recomendaciones para evitar caídas.
Entre las medidas tenemos:
- - Realizar osteodensitometría DXA con morfometría vertebral
- - Evaluar el calcio sérico, 25-OHvitamina D, calciuria en 24 hrs, TSH
- - Mantener un aporte de calcio oral de 1200 mg dia preferiblemente con lácteos bajos en grasa
- - Mantener un aporte mínimo de colecalciferol de 1000 UI día, previa corrección de la deficiencia de vitamina D
- - Promover el ejercicio diario
- - Entregar recomendaciones para evitar caídas.
1. Garcia
DA, Baglin TP, Weitz JI, Samama MM. Parenteral anticoagulants: Antithrombotic Therapy and
Prevention of Thrombosis, 9th ed: American College of Chest Physicians
Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2
Suppl):e24S-43S.
2. Rajgopal R, Bear M, Butcher MK, Shaughnessy
SG. The effects of heparin and low molecular weight heparins on bone. Thromb
Res. 2008;122(3):293-8.
3. Watts NB, Bilezikian JP, Camacho PM, et al.
American Association of Clinical Endocrinologists Medical Guidelines for
Clinical Practice for the diagnosis and treatment of postmenopausal
osteoporosis. Endocr Pract. 2010 Nov-Dec;16
Suppl 3:1-37.
4. Tooher R, Gates S, Dowswell T, Davis LJ.
Prophylaxis for venous thromboembolic disease in pregnancy and the early
postnatal period. Cochrane Database Syst
Rev. 2010 May 12; (5):CD001689.
5. Dahlman TC. Osteoporotic fractures and the
recurrence of thromboembolism during pregnancy and the puerperium in 184 women
undergoing thromboprophylaxis with heparin. Am J Obstet Gynecol. 1993
Apr;168(4):1265-70.
6. Barbour LA, Kick SD, Steiner JF, et al. A
prospective study of heparin-induced osteoporosis in pregnancy using bone
densitometry. Am J Obstet Gynecol. 1994 Mar;170(3):862-9.
7. Muir JM, Hirsh J, Weitz JI, Andrew M, Young
E, Shaughnessy SG. A histomorphometric comparison of the effects of heparin and
low-molecular-weight heparin on cancellous bone in rats. Blood. 1997 May
1;89(9):3236-42.
8. Vik A, Brodin E, Sveinbjornsson B, Hansen JB.
Heparin induces mobilization of osteoprotegerin into the circulation. Thromb
Haemost. 2007 Jul;98(1):148-54.
9. Irie A, Takami M, Kubo H, Sekino-Suzuki N,
Kasahara K, Sanai Y. Heparin enhances osteoclastic bone resorption by
inhibiting osteoprotegerin activity. Bone. 2007 Aug;41(2):165-74.
10. Kock HJ, Handschin AE. Osteoblast growth
inhibition by unfractionated heparin and by low molecular weight heparins: an
in-vitro investigation. Clin Appl Thromb Hemost. 2002 Jul;8(3):251-5.
11. Osip SL, Butcher M, Young E, Yang L,
Shaughnessy SG. Differential effects of heparin and low molecular weight
heparin on osteoblastogenesis and adipogenesis in vitro. Thromb Haemost. 2004 Oct;92(4):803-10.
12. Handschin AE, Trentz OA, Hoerstrup SP, Kock
HJ, Wanner GA, Trentz O. Effect of low molecular weight heparin (dalteparin)
and fondaparinux (Arixtra) on human osteoblasts in vitro. Br J Surg. 2005
Feb;92(2):177-83.
13. Matziolis G, Perka C, Disch A, Zippel H.
Effects of fondaparinux compared with dalteparin, enoxaparin and unfractionated
heparin on human osteoblasts. Calcif Tissue Int. 2003 Oct;73(4):370-9.
14. Papathanasopoulos A, Kouroupis D, Henshaw K,
McGonagle D, Jones EA, Giannoudis PV. Effects of antithrombotic drugs
fondaparinux and tinzaparin on in vitro proliferation and osteogenic and
chondrogenic differentiation of bone-derived mesenchymal stem cells. J Orthop
Res. 2011 Sep;29(9):1327-35.
15. Winkler T, Perka C, Matziolis D, Matziolis
G. Effect of a direct thrombin inhibitor compared with dalteparin and
unfractionated heparin on human osteoblasts. Open Orthop J. 2011; 5: 52–58.
16. Solayar GN, Walsh PM, Mulhall KJ. The effect
of a new direct Factor Xa inhibitor on human osteoblasts: an in-vitro study
comparing the effect of rivaroxaban with enoxaparin. BMC Musculoskelet Disord. 2011 Oct 28;12:247
17. Handschin AE, Egermann M, Trentz O, et al.
Cbfa-1 (Runx-2) and osteocalcin expression by human osteoblasts in heparin
osteoporosis in vitro. Clin Appl Thromb Hemost. 2006 Oct;12(4):465-72.
18. Casele H, Haney EI, James A, Rosene-Montella
K, Carson M. Bone density changes in women who receive thromboprophylaxis in
pregnancy. Am J Obstet Gynecol. 2006 Oct;195(4):1109-13.
19. Pettila V, Leinonen P, Markkola A, Hiilesmaa
V, Kaaja R. Postpartum bone mineral density in women treated for
thromboprophylaxis with unfractionated heparin or LMW heparin. Thromb Haemost.
2002 Feb;87(2):182-6.
20. Le Templier G, Rodger MA. Heparin-induced
osteoporosis and pregnancy. Curr Opin Pulm Med. 2008 Sep;14(5):403-7.
21. Rodger MA, Kahn SR, Cranney A, et al.
Long-term dalteparin in pregnancy not associated with a decrease in bone
mineral density: substudy of a randomized controlled trial. J Thromb Haemost.
2007 Aug;5(8):1600-6.
22. Sudrova M, Kvasnicka J, Kudrnova Z,
Zenahlikova Z, Mazoch J, Brzezkova R. Influence of long-term thromboprophylaxis
with low-molecular-weight heparin (enoxaparin) on changes of bone metabolism
markers in pregnant women. Clin Appl Thromb Hemost. 2011
Oct;17(5):508-13.
23. Wawrzynska L, Tomkowski WZ, Przedlacki J,
Hajduk B, Torbicki A. Changes in bone density during long-term administration
of low-molecular-weight heparins or acenocoumarol for secondary prophylaxis of
venous thromboembolism. Pathophysiol Haemost Thromb. 2003 Mar-Apr;33(2):64-7.
24. Ageno W, Gallus AS, Wittkowsky A, Crowther
M, Hylek EM, Palareti G. Oral anticoagulant therapy: Antithrombotic Therapy and
Prevention of Thrombosis, 9th ed: American College of Chest Physicians
Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2 Suppl):e44S-88S.
25. Morishima Y, Kamisato C, Honda Y, Furugohri
T, Shibano T. The effects of warfarin and edoxaban, an oral direct factor Xa
inhibitor, on gammacarboxylated (Gla-osteocalcin) and undercarboxylated
osteocalcin (uc-osteocalcin) in rats. Thromb Res. 2013
Jan;131(1):59-63
26. Abdelmohsen K, Stuhlmann D, Daubrawa F,
Klotz LO. Dicumarol is a potent reversible inhibitor of gap junctional
intercellular communication. Arch Biochem Biophys. 2005 Feb 15;434(2):241-7
.
27. Jeong HM, Cho DH, Jin YH, et al. Inhibition
of osteoblastic differentiation by warfarin and 18-alpha-glycyrrhetinic acid.
Arch Pharm Res. 2011 Aug;34(8):1381-7
28. Binkley N, Krueger D, Engelke J, Suttie J.
Vitamin K deficiency from long-term warfarin anticoagulation does not alter
skeletal status in male rhesus monkeys. J Bone Miner Res. 2007
May;22(5):695-700.
29. Simon RR, Beaudin SM, Johnston M, Walton KJ,
Shaughnessy SG. Long-term treatment with sodium warfarin results in decreased
femoral bone strength and cancellous bone volume in rats. Thromb Res. 2002 Feb 15;105(4):353-8.
30. Barnes C, Newall F, Ignjatovic V, et
al. Reduced bone density in children on long-term warfarin. Pediatr Res. 2005
Apr;57(4):578-81.
31. Ogura-Tomomatsu H, Asano K, Tomomatsu K, et al.
Predictors of osteoporosis and vertebral fractures in patients presenting with
moderate-to-severe chronic obstructive lung disease. COPD. 2012
Aug;9(4):332-7.
32. Gage BF, Birman-Deych E, Radford MJ,
Nilasena DS, Binder EF. Risk of osteoporotic fracture in elderly patients
taking warfarin: results from the National Registry of Atrial Fibrillation 2.
Arch Intern Med. 2006 Jan 23;166(2):241-6.
33. Gigi R, Salai M, Dolkart O, et al. The
effects of direct factor Xa inhibitor (Rivaroxaban) on the human osteoblastic
cell line SaOS2. Connect Tissue Res.2012: 53(6):446-50.
34. Somjen D, Katzburg S, Gigi R, et al.
Rivaroxaban, a direct inhibitor of the coagulation factor Xa interferes with
hormonal-induced physiological modulations in human female osteoblastic cell
line SaSO2. J Steroid Biochem Mol Biol. 2013: May;135:67-70.